La preocupación de mantener la condición corporal y el soporte alimenticio fue un aspecto subestimado durante muchos años en los servicios de internación y terapia intensiva lo que resulto en altos índices de desnutrición en los hospitales humanos.
Actualmente se observa en las clínicas veterinarias una situación parecida a la de los hospitales humanos de algunas décadas atrás. La terapia nutricional es raramente utilizada principalmente debido al desconocimiento de su técnica tanto como de los beneficios que ella propicia.
El soporte nutricional del paciente hospitalizado permite la administración de energía para la función celular, substratos para la síntesis proteica y vitaminas y minerales para los procesos metabólicos diarios y mantenimiento de la homeostasis .
Las células con tasas metabólicas elevadas son las primeras en ser afectadas por las deficiencias nutricionales, y en este grupo de células se incluyen las de los sistemas inmunológicos.
La utilización de proteínas corpóreas lleva a atrofia de la musculatura esquelética y disminución del tamaño y la funcionalidad de los órganos vitales.
La subnutrición de esos pacientes provee mayor tasa de mortalidad, morbilidad y mayor tiempo de internación (Donaghue,1992; Remillard, 2002).
De acuerdo a lo expresado por Remillard, 2002, en humanos la malnutrición está asociada a una mayor dependencia respiratoria y aumento de la tasa de complicaciones, días de internación y costos.
En un estudio realizado con 276 perros hospitalizados, apenas un 27% alcanzó un balance energético positivo.
Orton, 1986; Remillard, 2002; describieron la prevención del catabolismo de proteínas de tejidos vitales como objetivo primario. Esas proteínas son importantes en la producción de anticuerpos, en la cicatrización de heridas y metabolismo de drogas, pero en los casos de déficit energético pueden ser utilizadas para la producción de energía.
De acuerdo a Macintire et al., 2002; el ayuno prolongado en pacientes críticos lleva a la atrofia de la mucosa intestinal, permitiendo la translocación bacteriana, que es uno de los principales responsables de la muerte en los pacientes críticos. Este problema puede evitarse a través del soporte nutricional adecuado.
2. Indicaciones para iniciar el soporte nutricional
Diversos estudios ya comprobaron la importancia del soporte nutricional en la recuperación del paciente internado (principalmente en los hipermetabólicos), reduciendo el tiempo de internación, la morbilidad y mortalidad, cuando se indica correctamente y es realizado por un equipo capacitado.
El objetivo de la terapia nutricional es al preservación o recuperación de la masa corporal proveyendo sustratos energéticos (glucosa, lípidos), y estructurales (aminoácidos y proteínas), garantizando las funciones y el mantenimiento del organismo.
De esta forma se previene el catabolismo y sus consecuencias, brindando las condiciones para una recuperación más rápida del paciente.
No existe un método ideal para identificar la necesidad de soporte nutricional en pequeños animales. En la práctica veterinaria se utiliza la evaluación de la historia, examen físico, score corporal y pruebas de laboratorio.
la pérdida aguda de 10% del peso o crónica del 20% son indicadores para iniciar la nutrición del paciente.
Otro método es la evaluación de la historia del animal, luego de 2 o 3 días de anorexia el animal comienza a usar proteínas de tejidos vitales. Animales con grandes pérdidas por vómitos, diarreas, heridas, quemaduras, cirugías o concentraciones de albúmina sérica < 2,5g/dl, poseen indicadores para comenzar el soporte nutricional .
Remillard, 2002; indica el inicio de la administración de nutrientes al paciente apenas se encuentre estable en cuanto a fluidos, electrolitos y de las anormalidades ácido-básicas.
El ideal es que se consiga iniciar la nutrición sólo 24 horas después de la lesión, comienzo de la enfermedad o presentación en la clínica.
Cada 24 horas de atraso aumentan los riesgos de complicaciones . Es importante recordar que incluso en animales obesos, a pesar del exceso de grasa corporal, se da el consumo de proteínas como fuente energética en los pacientes anoréxicos.
La indicación y utilización de soporte nutricional, se puede basar en 5 principios:
• No hay enfermedad que se beneficie del ayuno o de la sola infusión de glucosa al 5% como aporte calórico nutricional
• La desnutrición progresiva lleva a atrofia de órganos vitales
• El aumento de la severidad de la desnutrición está asociado al aumento de la morbilidad y mortalidad
• Existe una única indicación para el uso de soporte nutricional: mantener el estado nutricional
• Cuando fuera empleado, el soporte nutricional debe ser indicado lo más rápidamente posible, antes que la desnutrición se desarrolle (especialmente en el paciente crítico) o tan luego sea diagnosticada.
Frente a un paciente candidato a terapia de soporte nutricional, se necesita la observación de los siguientes:
• ¿El tracto gastrointestinal del paciente es funcional? ¿Es capaz de absorber nutrientes? ¿Es necesario mantener un reposo enteral temporal (como en el caso de la pancreatitis aguda o el vómito persistente)?
• ¿Por cuánto tiempo se estima que el paciente requerirá soporte nutricional?
• Está el paciente conciente? ¿Hay riesgo de vómito y/o aspiración?
• ¿Cuál es el pronóstico del animal?
Las vías enteral y parenteral pueden ser utilizadas para brindar soporte nutricional, existiendo dentro de la nutrición enteral la fluidoterapia microenteral.
Los factores que serán considerados al elegir la vía de acceso son:
§ tiempo estimado de duración de la terapia nutricional,
§ estado de conciencia del paciente,
§ Funcionalidad del tracto digestivo,
§ temperamento del paciente,
§ existencia de enfermedades que interfieran o deben ser consideradas en la nutrición (pancreatitis y diabetes, insuficiencia hepática, renal o cardiaca, por ejemplo),
§ estado general del paciente,
§ la condición financiera del propietario,
§ experiencia del médico responsable.
3. Requerimiento energético Basal (REB)
La fórmula de alimentación ideal debe:
- ser bien tolerada y digerida rápidamente por el paciente,
- contener los nutrientes esenciales,
- ser de fácil obtención,
- adecuada para la mayoría de los pacientes
- estable, impidiendo el crecimiento bacteriano luego de abierto el envase.
La cantidad de alimento depende de las necesidades de cada paciente .
El requerimiento energético basal (REB) es la cantidad de energía necesaria para las actividades básicas del paciente .
Puede ser calculado por la seguiente fórmula:
REB = (30 x Peso) + 70,
Y para los animales con menos de 2 kg o más de 45 kg:
REB = 70 x P 0,75 , donde P = peso del animal
4. Nutrición Enteral
El soporte nutricional puede ser realizado por la vía gastrointestinal (enteral) o por la vía endovenosa (parenteral), suprimiendo principalmente las necesidades de aminoácidos; lípidos, carbohidratos, vitaminas y minerales.
Cuanto más semejante a la alimentación fisiológica, se origina menos stress y son menos las consecuencias adversas que se generan, en este punto es importante destacar que las fórmulas enterales son siempre preferidas cuando no hay contraindicaciones .
El tracto gastrointestinal debe utilizarse siempre que sea posible, o sea, la alimentación por la vía enteral es de primera elección en la terapia de soporte nutricional. Esta opción se basa en un menor costo, menor incidencia de complicaciones, facilidad de la técnica y principalmente por la preservación del tracto gastrointestinal y los beneficios asociados.
Diverso trabajos demuestran que la utilización de esta vía de acceso presenta un menor índice de complicaciones como septicemia, neumonía, abscesos, dehiscencia de suturas gastrointestinales y otros.
La nutrición enteral consiste en proveer nutrientes para el paciente a través de la utilización de alguna porción del tracto digestivo. Diversas técnicas están disponibles, algunas son de fácil acceso como la alimentación oral forzada con jeringa, existiendo también vías que requieren procedimientos quirúrgicos para su implementación, como la colocación de un tubo de gastrotomía por vía endoscópica percutánea.
La principal ventaja de la vía enteral en la nutrición clínica es el mantenimiento de la integridad del tracto gastrointestinal y de su funcionalidad. La desnutrición aguda resulta en alteraciones de la mucosa intestinal de los animales, como reducción de las vellosidades, de la proliferación celular y la pérdida de proteínas induciendo alteraciones en su integridad y aumento de la permeabilidad a macromoléculas.
Se cree que estos factores contribuyen para que se dé el fenómeno de translocación bacteriana (las bacterias se translocan del intestino a la cadena linfática mesentérica y luego al torrente sanguíneo diseminándose por el resto del organismo. La translocación bacteriana es preocupante en pacientes críticos y está asociada con la ocurrencia de septicemia y falla multiorgánica.
Es de extrema importancia el cálculo correcto de los requerimientos del animal, dado que la sobrealimentación principalmente en los pacientes críticos es tan perjudicial como la desnutrición.
No se debe administrar más de 30 – 45ml/kg de la dieta en cada ingesta para evitar estimular el vómito. La dieta debe ser administrada en bolos, dividiendo la cantidad total por el número de veces que se proporcionará alimento.
Los pacientes con ayuno o anorexia prolongada no deben recibir los requerimientos totales hasta las primeras 72 horas. El ideal es iniciar la administración con un volumen inferior (mitad o tercio del requerimiento total) y observar las posibles reacciones gastrointestinales como vómito o diarrea.
Se pueden utilizar dietas enterales líquidas formuladas para uso humana conforme con las indicaciones terapéuticas. En este caso se debe prestar atención respecto a los diferentes requerimientos nutricionales entre las especies humana, canina y felina cuando se utiliza esa dieta por períodos más prolongados. Las dietas balanceadas para mascotas pueden ser licuada con agua hervida, y administradas a través de sondas. Luego de cada administración el lavado de la sonda mediante la inyección de agua con una jeringa previene futuras obstrucciones y acúmulo de alimentos.
4.1 Fluidoterapia microenteral
La fluidoterapia microenteral se basa en el principio de que el mantenimiento de la barrera física y estructural del tracto gastrointestinal es fundamental en la prevención de la translocación bacteriana. Su principal objetivo es proteger la barrera mucosa estomacal y mantener funcional el tracto digestivo, aumentando el flujo sanguíneo, previniendo su atrofia y las disfunciones mecánicas, mientras la ingestión per os de alimentos no esta permitida.
Es importante resaltar que la fluidoterapia microenteral aislada no nutre al paciente por lo que está indicada su asociación con nutrición parenteral cuado es necesario un reposo prolongado del tracto gastrointestinal, lo que al preservar la salud del tracto gastrointestinal permite la institución de la terapia enteral completa con mayor rapidez.
4.2 Medios de administración
La nutrición enteral puede ser realizada de modo voluntario o involuntario. El primero causa menos stress al paciente, además de ser más fácil de realizar, pero en algunos casos es necesario implementar otros métodos.
Siempre que el paciente esté ingiriendo por lo menos 75% de la cantidad ideal, la ingestión voluntaria deberá ser mantenida. De acuerdo con un estudio realizado en un hospital escuela, de 1100 animales (840 perros y 260 gatos), en 84% de los caninos y 68% de los felinos (con una media del 81% de los animales) que recibieron soporte nutricional, fue posible realizar un soporte nutricional voluntario.
Cuando el animal no presenta voluntad de comer es posible realizar algunas maniobras como ofrecer el alimento con las manos, calentar el alimento, u ofrecer alimento casero balanceado de alta palatabilidad. También se puede realizar alimentación forzada con el auxilio de una jeringa de alimentación (presenta un orificio mayor) colocando el alimento en la boca del animal. Muchas veces este procedimiento estimula la ingestión.
Los métodos de soporte nutricional involuntários se utlizan siempre que el paciente no presenta condiciones de ingerir todas las kilocalorias necesarias por su propia cuenta. Se utilizan diversos tipos de sondas y tubos, pero la regla siempre sugiere que se utilice la via más fisiológica, o sea, desde la boca hacia el intestino. Podemos utilizar las siguientes opciones:
Sonda nasogástrica
Fácil de ser implementada, efectiva y eficiente. Para insertarla es necesário solamente unas gotas de anestesia tópica en la cavidad nasal y una buena lubricación de la sonda con gel.
La sonda pueda quedarse bien entre tres y siete dias, pero ocasionalmente puede estar más tiempo. El primer gran objetivo de la sonda nasogástrica no es el de alimentar sino el de aspirar el estómago. Todos los animales que vomitan necesitan ayuda para disminuir la presíon por la dilatación debido a los gases y liquidos retenidos cuándo hay inflamación pilórica grave.
 |
| La longitud del catéter nasal se mide desde la punta de los ollares hasta la última costilla para ubicarlo en el esófago distal. |
 |
Se coloca una tubuladura de goma de diámetro interno pequeño a nivel del meato nasal ventral. Para los pequeños pacientes se utilizan sonda k33 – k35; y para perros grandes se emplean sondas k-31. |
 |
| Revisar la ubicación: si el paciente está sedado, visualice el tubo para asegurarse de que no ha avanzado en la tráquea. |
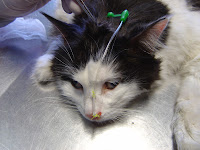 |
Un segundo punto se coloca en la zona lateral de la cara o en el puente nasal, entre los ojos. Colocar al animal un collar isabelino. |
 |
Colocar al animal un collar isabelino. |
Esofagostomía
Es la técnica más indicada cuando hay problemas en cavidad oral, nasal o faringe que impidan la alimentación. Muy rápida de ejecutar, necesita solamente sedación o inducción rápida del paciente con anestesia local. El tubo puede quedarse hasta meses, y en los gatos con lipidosis hepática es la técnica de elección en la terapéutica inicial.
No hay tiempo de espera para quitar el tubo y pude iniciarse la alimentación inmediatamente trás su colocación.
Gastrostomía
Unicamente indicada si el esófago no es funcional. Necesita anestesia general, el tubo no puede retirarse en los primeros 7–10 días hasta que se fije la gastropexia y hay que esperar por lo menos 24 h para iniciarse la alimentación. Los riesgos son mucho más grandes y las complicaciones más frecuentes. La técnica endoscopia es la más indicada.
Siempre que pueda existir la posibilidad de una esofagostomia o faringostomia deben ser preferidas.
Yeyunostomía
Está indicada en todos los casos donde el estómago no pueda recibir alimento o cuando el páncreas es el foco principal de problemas. Las desventajas son las mismas del tubo de gastrostomía cuando se utiliza la vía quirúrgica pero si se utiliza la vía endoscópica nasogástrica es una gran herramienta de apoyo en la recuperación del paciente grave, a bajo costo y sin ningún riesgo de complicación.
5. Nutrición parenteral
La nutrición parenteral consiste en la administración de nutrientes a través de una vía diferente al tracto gastrointestinal, usualmente intravenoso. Está indicada en los caso en que el tracto digestivo no sea funcional o en los casos en que es necesaria la no estimulación del órgano (debido a la ocurrencia de vómito o regurgitación, pancreatitis, obstrucción intestinal, pacientes con riesgo de aspiración pulmonar y en algunos contados post-operatorios). Además de completar la nutrición enteral cuado el paciente no es capaz de recibir todo su requerimiento nutricional por esta vía.
Puede ser administrada a través de un acceso central como la vena yugular, o periférico como la vena cefálica, conforme con la osmolaridad de la solución.
Las soluciones hiperosmolares (usualmente aquellas en las que la glucosa es la fuente predominante de energía) no deben ser administradas por la vía periférica, pues pueden resultar en flebitis y necrosis local. Normalmente la nutrición parenteral está compuesta de aminoácidos, glucosa y lípidos.
En su utilización se debe estar muy atento a la asepsia, en la preparación, la conservación de las soluciones, así como en la introducción y mantenimiento del catéter, que debe ser de uso exclusivo para la nutrición parenteral, reduciendo los riesgos de complicaciones como la septicemia.
Los componentes deben ser adicionados en secuencia: glucosa, aminoácidos y lípidos ya que la mezcla directa de este último con la glucosa puede romper la emulsión, precipitando con los otros componentes, lo que es verificable visualmente. Luego de preparado debe utilizarse en forma inmediata o refrigerado a 4ºC por hasta 2 días, lo mismo con las soluciones parcialmente utilizadas.
La administración debe ser continua, a través de una bomba de infusión, o de ser necesario, en ciclos cada 12-15 horas cuando no es posible monitorear al paciente las 24 horas, lo que predispone a la ocurrencia de complicaciones metabólicas.
La interrupción repentina puede llevar a hipoglucemia de rebote, principalmente cuando se utiliza una solución con un nivel de glucosa superior al 25%. Se puede prevenir este disturbio administrando, glucosa al 5% por algunas horas al principio de cada período de intervalo o cuando se discontinúa la infusión de la alimentación parenteral.
También se puede ir reduciendo paulatinamente la concentración de glucosa, 10 a 12 horas antes
de discontinuar la terapia.
Las posibles complicaciones mecánicas, metabólicas y/o sépticas de la nutrición parenteral convierten a la monitorización del paciente uno de los factores más importantes de la terapia.
La translocación bacteriana es otra fuente de infección lo que refuerza la importancia de la alimentación enteral o microenteral precoz, incluso asociada a la alimentación parenteral.
En el paciente crítico, la terapia nutricional debe ser incluida lo antes posible, en cuanto su cuadro hemodinámico, electrolítico y ácido-básico estuviera estabilizado. La institución precoz del soporte enteral auxilia en la prevención de la multiplicación y translocación bacteriana y reduce la absorción de endotoxinas y citotoxinas, principalmente cuando se asocia a nutrientes específicos como la glutamina.
6. Consideraciones Finales
La terapia de soporte nutricional es un herramienta auxiliar muy importante en el tratamiento, principalmente en los pacientes en estado hipermetabólico. Su utilización se basa en la correcta evaluación del estado del animal, pues cuando es mal utilizada puede ocasionar complicaciones fatales.
La dieta, el volumen administrado, la vía utilizada y la velocidad de infusión deben ser estudiadas y calculadas para cada paciente.
El monitoreo constante del animal es fundamental para el éxito de la terapia y la prevención de disturbios metabólicos, especialmente cuando se utiliza la vía parenteral.
Los beneficios del soporte nutricional ya fueron comprobados en diversos estudios y esta terapia no debe ser olvidada por el médico veterinario, ya que asocia a la naturaleza con en cariño y confort que el animal necesita.
La utilización de la vía de acceso enteral es relativamente simple y segura, barata y mucho más eficiente cuando es instaurada precozmente en el paciente crítico hipermetabólico. Incluso si los requerimientos nutricionales del animal no puedan ser prevenidos en su totalidad por esta vía, la estimulación del tracto gastrointestinal a través de la nutrición enteral o de la fluidoterapia microenteral, asociados a la nutrición parenteral es extremadamente benéfica para el paciente.
La nutrición enteral debe ser realizada siempre que sea posible en pacientes que no poseen contraindicaciones. Las diversas técnicas disponibles para la obtención de un acceso enteral deben ser exploradas al máximo, posibilitando que la nutrición sea proporcionada manteniendo la fisiología normal del organismo del animal, respetando la regla de oro de la nutrición clínica : “si el intestino está funcional,¡¡¡Úselo!!!”-.
En animales hospitalizados es posible disminuir las tasas de morbilidad y mortalidad. El aumento relativo del costo utilizando las técnicas puede ser compensado por la disminución del tiempo de recuperación, consecuentemente disminuyendo el tiempo de internación del paciente. Además, cabe resaltar que en la actualidad las nuevas técnicas que permiten al paciente obtener la mejor calidad de vida posible.



